DETERMINACIÓN DE SULFATOS
1-OBJETIVO:
Aprender a usar el espectrofotómetro y determinar la concentración de sulfatos de una muestra de agua.
2-FUNDAMENTO:
Los sulfatos suelen ser sales solubles en agua a excepción de los de Pb, Ba y Sr por lo que se hayan profusamente repartidos en todas las aguas. El origen de este ión en las aguas se debe fundamentalmente a los procesos de disolución de yesos (sulfato de calcio) sin olvidar las cantidades procedentes de la oxidación de los sulfuros.
El fundamento de esta determinación es la reacción entre el anión sulfato y el catión Ba para formar un producto insoluble, que con ayuda de suspensión de goma arábiga permanece en disolución un tiempo adecuado para su análisis turbidimétrico.
Los sulfatos se encuentran en las aguas naturales en un amplio intervalo de concentraciones. Las aguas de minas y los efluentes industriales contienen grandes cantidades de sulfatos provenientes de la oxidación de la pirita y del uso del ácido sulfúrico.
3-MATERIAL:
- 3
pipetas de 10ml
- Cristal
de reloj
- Prepipeta
-
Mortero
- Gradilla
- Tubos de ensayo
-
Embudo
-
Probeta
-
Pipeta Pasteur
- H2SO4 (ácido sulfúrico)
-
BaCL2 (cloruro de bario)
4-PROCEDIMIENTO:
Primero debemos realizar la siguiente reacción:
BaCl2
+ H2SO4
→ BaSO4 (insoluble)
El sulfato de bario al
ser insoluble precipita y aumenta la turbidez.
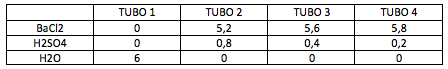
Se hace una batería de
disoluciones de sulfúrico pero siempre con la misma cantidad de
BaCl2. Se realiza en los tubos de ensayo:
BaCl2 → 100ml al 0,0962N H2SO4 → 100ml al 0,2N
Con estas
disoluciones hacemos una recta de calibrado siguiendo estos pasos:
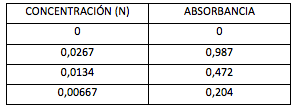
1- Crear una tabla con la Concentración y la absorbancia de las disoluciones anteriores. Para hallar la concentración se usa la formula: C · V = C · V
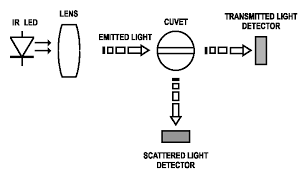
La absorbancia se mide en el espectrofotómetro, el que disponemos en nuestro laboratorio es el siguiente:
Mediremos con el espectrofotómetro a 650nm.
Tras esto ya tenemos nuestra tabla con concentración y absorbancia:
2- Con estos datos calcular primero el Coeficiente de regresión (r), y posteriormente calcular la ecuación de la recta.
Os adjunto foto de los procedimientos matemáticos y los resultados:
3- Por último medimos la absorbancia de nuestra muestra en el espectrofotómetro para ello habrá que añadirle también BaCl2.
Después de la medición nuestra absorbancia nos ha dado A = 0,382
Ahora para saber la concentración basta con sustituir en la ecuación la Y y hallar la X.
5-CÁLCULOS:
Están adjuntados en el apartado anterior.
6-RESULTADO:
La medición de nuestra muestra da A = 0,382.
Basta con sustituir en nuestra ecuación por la Y y hallar la X de esta manera:
X = (0,382 + 0,018) : 36,21 = 0,011
El resultado sería que tenemos una concentración de sulfatos de 0,011N